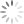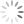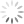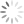O CO, é um óxido ácido que, ao se dissolver na água, reage formando o HCO... O HCO, se
ioniza em função do pH da água de acordo com as seguintes equações químicas:
H,CO, + OH == HCO; + H,O
HCO; + OH === CO? + HO
O gráfico a seguir relaciona a fração em mol de cada um dos três compostos de carbono acima,
em função do pH.
1,0
0,9
0,8
0,7
0,6
0,5
0,4
0,3
0,2
0,1
0,0
fração em mol
A análise de uma amostra de 100 mL de água indicou a presença de 0,04 mol de COZ e valor
de pH igual a 10.
Determine a concentração, em mol/L, de íons HCO; nessa amostra. Nomeie, também, as
espécies químicas HCO, e HCO, presentes na solução aquosa.