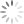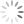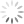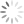O boato de que os lacres das latas de alumínio teriam
um alto valor comercial levou muitas pessoas a juntarem
esse material na expectativa de ganhar dinheiro com sua
venda. As empresas fabricantes de alumínio esclarecem
que isso não passa de uma “lenda urbana”, pois ao retirar
o anel da lata, dificulta-se a reciclagem do alumínio. Como
a liga do qual é feito o anel contém alto teor de magnésio,
se ele não estiver junto com a lata, fica mais fácil ocorrer
a oxidação do alumínio no forno. A tabela apresenta as
semirreações e os valores de potencial padrão de redução
de alguns metais:
a x Potencial Padrão de
Semirreação
Redução (V)
Li+e —Li -3,05
K+e > K 293
Mg +26 Mg 296
AB +36 >A —1,66
Zn? + 2e-— Zn
Cu +2e — Cu
Disponivel em: ww sucatas com, Acesso em: 28 ev. 2012 (adaptado)
Com base no texto e na tabela, que metais poderiam
entrar na composição do anel das latas com a mesma
função do magnésio, ou seja, proteger o alumínio da
oxidação nos fornos e não deixar diminuir o rendimento
da sua reciclagem?
O Somente o lítio, pois ele possui o menor potencial de
redução.
O Somente o cobre, pois ele possui o maior potencial
de redução.
OB Somente o potássio, pois ele possui potencial de
redução mais próximo do magnésio.
© Somente o cobre e o zinco, pois eles sofrem oxidação
mais facilmente que o alumínio.
@ Somente o lítio e o potássio, pois seus potenciais de
redução são menores do que o do alumínio.