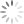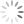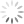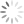De acordo com a teoria atômica de Dalton, os átomos eram considerados maciços e indestrutíveis, sendo preservados
intactos nas transformações químicas. Além disso, o que diferenciava um elemento químico de outro era o peso de seus
átomos. Em sua teoria, Dalton não admitia a união entre átomos de um único elemento químico. Átomos de elementos
químicos diferentes poderiam se unir, formando o que Dalton denominava “átomos compostos”.
À imagem mostra os símbolos criados por Dalton para representar os elementos químicos hidrogênio e nitrogênio e a subs-
tância amônia. Ao lado, há uma tabela com os pesos atômicos relativos estimados por Dalton para esses dois elementos.
(+) hidrogênio
Elemento Peso atômico
(D nitrogênio hidrogênio 1
nitrogênio 4,2
(XD amônia
(James R. Partington. A short history of chemistry, 1957. Adaptado.)
a) Escreva a equação da reação de formação da amônia a partir de hidrogênio e nitrogênio, de acordo com a teoria de
Dalton. Escreva a equação dessa reação de acordo com os símbolos e conhecimentos atuais.
b) Calcule a razão entre os pesos de nitrogênio e de hidrogênio na amônia, tal como considerada por Dalton, e compare
esse resultado com a razão entre as massas desses elementos na molécula de amônia, tal como conhecemos hoje.
Admitindo como correta a razão calculada com base nos conhecimentos atuais, indique a diferença percentual, aproxi-
madamente, entre as duas razões calculadas.